钙
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
暗沉的灰色,銀色  鈣的原子光譜 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 钙(Calcium)·Ca·20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 碱土金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 2 ·4·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 40.078(4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氩] 4s2 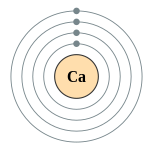 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 汉弗里·戴维(1808年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 漢弗里·戴維(1808年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 1.55 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 1.378 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 1115 K,842 °C,1548 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 1757 K,1484 °C,2703 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 8.54 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 154.7 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 25.929 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | +2, +1[1] (強鹼性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.00(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:589.8 kJ·mol−1 (更多) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 176±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 231 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)33.6 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 201 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)22.3 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (20 °C)3810 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 20 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 7.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 17 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 1.75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 167 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-70-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钙的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钙(Calcium)是一種化学元素。其化学符号是Ca,原子序数是20。鈣是银白色的碱土金属,具有中等程度的軟性。雖然在地殼的含量也很高,為地殼中第五豐富的元素,占地殼總質量3%[2],因其化學活性頗高,可以和水或酸反應放出氫氣,或是在空氣中便可氧化(形成緻密氧化層(氧化鈣)),因此在自然界多以離子狀態或化合物形式存在,而沒有单质存在。在工業的主要礦物來源如石灰岩、石膏等,在建筑(水泥原料)、肥料、制鹼、和医疗上用途佷广。
目录
1 同位素
2 發現
3 製備
4 用途
5 自然界的鈣
6 對人體的影響
6.1 人體的含量與分布
6.1.1 骨骼鈣
6.1.2 牙齒鈣
6.1.3 血鈣
6.2 消化與吸收
6.3 攝取量
6.4 食物來源
6.5 鈣補充劑
6.6 與其他營養素之關係
6.7 鈣與疾病預防
6.8 钙信号
7 参考文献
同位素
自然界有6種天然同位素存在,不过只有其中3种是稳定的(鈣-43,鈣-42,鈣-44),另有11種放射性同位素。
發現
1808年,英国的戴维、瑞典的贝采利乌斯、法国的蓬丁,使用汞阴极电解石灰石制得在电解质,在阴极的汞齐中提出金属钙。
從此鈣被確定為元素,並被命名為Calcium,元素符號是Ca{displaystyle {{ce {Ca}}}}

鈣的焰色
製備
有電解法及还原法兩種方式。
其中電解法是拉特瑙(W.Rathenau)於1904年首先應用的,所用的電解質為CaCl2和CaF2的混合物。電解槽陽極用石墨等作內襯,陰極用鋼製成。電解析出的鈣漂浮在電解質表面,同鋼製陰極接觸而冷凝在陰極上。
还原法是生產金屬鈣的主要方法。通常用石灰石為原料,經燒成氧化鈣,以鋁粉作還原劑。粉碎的氧化鈣與鋁粉按一定比例混合均勻,壓製成塊。

鈣在常溫下即可與水作用放出氫氣

鈣與水作用生成氫氧化鈣
用途
钙可用作合金的脱氧剂,以及油类的脱水剂等。
自然界的鈣
通常水中含鈣鎂離子即稱之為硬水。而硬度是由水溶液中的礦物質含量多寡而決定,而且會特別指CaCO3{displaystyle {{ce {CaCO3}}}}




對人體的影響
鈣是人體必需的礦物質營養素,所有的細胞都需要鈣。鈣離子Ca2+{displaystyle {ce {Ca^{2+}}}}

現代醫學研究表明,鈣營養與體內免疫、神經、內分泌、消化、循環、運動、生殖等十多個系統的功能密切相關,鈣離子參與生命進化及生命運動的全過程。基礎醫學臨床醫學的研究已證實鈣離子對生命的影響巨大,也就是說人類健康離不開鈣[3]。
人體的含量與分布
人體的鈣含量約1~1.25kg,占體重1.5~2%,鈣原子數目僅次於C{displaystyle {ce {C}}}



骨骼鈣
鈣是骨骼、牙齒和細胞壁形成時的必需結構成分。骨鈣的組成主要是羥磷灰石結晶,占骨骼重量40%以上,其次是碳酸鹽、檸檬酸鹽以及少量氯化物和氟化物的形式。骨鈣對維持血鈣的濃度極為重要,被稱作人體鈣元素的「儲存庫」。當血鈣濃度降低時,可迅速動員骨鈣補充,此過程即為骨質分解;反之鈣則在骨骼「暫存」。
牙齒鈣
牙齒的化學組成大部分與骨一致,牙齒的表層為牙釉質(又稱琺瑯質),除了5%水外,全部由嵌入有機基質中的無機物(羥磷灰石及氟磷灰石)組成。其中羥磷灰石所占比例超過98%,結構非常嚴密,成為人體中最硬的部分,對牙齒咀嚼、磨碎食物具有重要意義。牙本質中羥磷灰石占70%左右,牙骨質中約占40%,它們的結構與骨類似。牙齒一旦形成和鈣化後,新陳代謝就降到最低程度。維生素A、C、D的攝取,對牙的正常發育及鈣化是必不可少的。缺少維生素A會導致牙的不完全鈣化,使其硬度小;缺少維生素C影響牙中有機基質的形成;維生素D不但能幫助鈣的吸收而且明顯地促使鈣、磷在牙中的沉積。
血鈣
血漿中的鈣有48%為離子形式,46%與蛋白質結合,3%為複合物形式(Complex),還有3%未被確認。血漿中鈣濃度大約為10~11 mg/100 mL,無年齡、性別差異。鈣離子對神經組織有特殊且重要的影響,如果血鈣離子濃度下降,神經組織會過度興奮,導致手足抽搐;另一方面,高血鈣抑制神經興奮,短期引致尿毒症,如多尿、水腫、頭痛、頭暈、夜尿、腰痛、眼矇,長遠導致腎結石、骨骼早閉即停高、腎功能受損及腎衰竭。血鈣的濃度相當穩定,由副甲狀腺素(PTH)精密控制,使骨鈣和血鈣處於平衡之中。血鈣濃度低,則由骨鈣補充;反之,血鈣濃度高,則將鈣沉積於骨中儲存,或經腎臟於尿中排出體外。
消化與吸收
維他命D在小腸對鈣的吸收中扮演重要的角色,它可增加小腸細胞膜上和細胞質的鈣結合蛋白質的總量。維他命D缺乏者會因為鈣吸收不足而易患有軟骨病(佝僂病)。
攝取量
世界各地區的鈣攝取量有很大的差異,歐美等發達國家平均毎人每日攝取850毫克,而非洲、拉丁美洲及大部分發展中國家只有344毫克,相差一倍以上。因此鈣攝取不足在發展中國家是個嚴重的健康議題[4]。
| 年齡別 | 台灣(mg每天)[5] | 美國(mg/day) [6] | |
| 0~6個月 | 400 | 400 | |
| 6個月~6歲 | 500 | 600-800 | |
| 7~9歲 | 600 | 800-1200 | |
| 10~12歲 | 700 | 1200-1500 | |
| 13~19歲 | 男800/女700 | 1200-1500 | |
| 20歲以上 | 600 | 24歲:1200-1500 | |
| 25~64歲:1000 | |||
| 65歲以上1500 | |||
| 懷孕及哺乳 | 1100 | 1200-1500 | |
| 成年婦女停經後 | 服用雌性素:1000 | ||
| 未用雌性素:1500 |
食物來源
自然的食品以牛奶和優酪乳所含的鈣最多,其他食物如乾豆類、魚、豆腐、深色的蔬菜如花椰菜、甘藍類蔬菜和芥蘭菜等都含有豐富的鈣。此外還有很多添加鈣強化的食物,例如:橙汁、蔓越莓汁、早餐穀類食品等。也有人服用鈣補充劑以補不足。然而攝取過量的鈣後果非常嚴重會引致高血鈣,繼而腎結石。最新的膳食標準指出鈣的上限攝取量是每天2500 mg;一般人每天只須從自然食物和補充劑中攝取1500 mg的鈣,即一天500mg的的補充劑便相當足夠。
[7][8][9][10]
鈣補充劑
鈣補充劑的主要成分為鈣化合物,如碳酸鈣、檸檬酸鈣、乳酸鈣等[11],其中吸收率最高的為檸檬酸鈣約35%,碳酸鈣為27%,乳鈣質為29%,磷酸鈣為25%。碳酸鈣取材於牡蠣殼或珍珠貝等,葡萄糖酸鈣的溶解度較大。選購鈣補充劑應注意鈣離子的含量與鈣的來源。
與其他營養素之關係
維生素D有利於鈣質的吸收與利用。磷與鈣會相互拮抗競爭,影響彼此的吸收。飲食的鈣磷比例對嬰兒非常重要,比例失調會導致抽筋,對兒童及成人則較無影響。理論上鈣磷攝取是以1:1{displaystyle 1:1}

鈣與疾病預防
攝取足夠鈣質可以「預防」骨質疏鬆症、直腸癌、降低男性前列腺癌的風險、維持血壓平衡。每天至少補充約800毫克的鈣質是最有效預防直腸癌的鈣攝取量,更年期婦女補充足夠的鈣質可以提高高密度脂蛋白(HDL)的濃度,這代表降低心血管疾病的風險與致命性。食用含钙多的食物,会使燃脂效果更佳,达到减肥效果。
攝取過量的鈣也會引起骨質疏鬆
骨骼中的軟組織(Soft tissue)含有鎂與蛋白質等,藉此賦予骨骼活動性以及抗脆性。實驗結果顯示補充鎂可改善停經婦女的骨質疏鬆的問題,可增加其骨質密度(Bone mineral density),並且降低骨折機率。補充鎂也會使副甲狀腺素(Parathyroid hormone,PTH)的濃度下降,推論鎂可以抑制骨質轉換,降低骨質流失而維持骨質健康。
但鎂與鈣互相拮抗,攝取過量的鈣會大幅降低鎂的吸收,故鈣只能預防。
钙信号
植物细胞能够探知病原体,从而激发一个让植物对感染产生抵抗力的防卫系统。植物防卫通道中一个最早的步骤涉及胞质溶解钙水平的增加。然而,Ca2+{displaystyle {ce {Ca^{2+}}}}
参考文献
^ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias. Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(μ-C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes. Journal of the American Chemical Society. 2010, 132 (35): 100818110534020. PMID 20718434. doi:10.1021/ja105534w.
^ 柯清水 編著. 【新世紀化工化學辭典】 The new century dictionary of chemical engineering and chemistry. 第一版. 正文書局. 2000[民89]: p.355. ISBN 957-40-0253-5. 请检查|date=中的日期值 (帮助) 引文格式1维护:冗余文本 (link)
^ Gropper SS, Groff JL, et al. (2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 380-392. Wardswirth, ISBN 978-0-534-55986-1
^ WHO/FAO (2004) Vitamin and mineral requirements in human nutrition, 2nd ed, pp.59-93. WHO:Geneva.
^ 行政院衛生署(2003)國人膳食營養素參考攝取量及其說明,修訂第六版,pp. 257-298。台灣行政院衛生署,ISBN 978-957-01-4677-6
^ Institute of Medicine (1997) Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. pp. 71-145. National Academy Press, ISBN 978-0-309-06403-3
^ 存档副本. [2007-12-24]. (原始内容存档于2005-04-05).
^ http://www.jtf.org.tw/educate/fitness/swimg/011_061.gif[永久失效連結]
^ http://www.jtf.org.tw/educate/fitness/swimg/011_062.gif[永久失效連結]
^ 存档副本. [2007-12-24]. (原始内容存档于2008-03-05).
^ 我们要不要补钙
元素周期表(碱土金属) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
| |||||||||||||
|


